使用靶向 HER2 的银纳米粒子进行光热疗法可缓解癌症
关注我们,为您推送更多最新研究。

研究背景
表现出局部表面等离子体共振 (Localized Surface Plasmon Resonance, LSPR) 现象的纳米粒子有希望应用于癌症的诊断与治疗。在广泛使用的金属纳米粒子中,银纳米粒子 (Ag NPs) 具有最强的光散射和表面等离子体强度,但它的治疗潜力长期以来都被低估了。药物靶向递送方法的发展显著提高了基于纳米颗粒的抗癌药物 (包括金属纳米颗粒) 的性能。在此基础上,来自莫斯科物理技术学院的 Shipunov 博士及其团队在 Pharmaceutics 期刊发表了文章,将使用狭叶薰衣草的水提取物进行绿色合成所产生的银纳米粒子和抗 HER2 亲和体 ZHER2:342 组合成高度特异性纳米药物,成功地对 HER2 过表达肿瘤进行了光热治疗 (Photothermal Therapy, PTT),靶向 Ag NPs 与光照射相结合使癌症完全消退。这表明,配备亲和体的靶向银纳米粒子可作为利用局部热疗效应抑制 HER2 过表达肿瘤的有效工具。
研究内容
本研究的实验设计包含两个部分,一是银纳米粒子的合成、表征和改性;二是纳米粒子与细胞的相互作用、体外的细胞毒性和体内的抗癌活性研究。
首先,作者利用绿色合成技术提取银纳米粒子,并通过 PEG 修饰,为粒子配备了抗 HER2 支架蛋白,即亲和体 ZHER2:342,从而引入癌细胞靶向功能;接下来,在体外验证了对癌细胞的光热治疗;最后,研究了 NPs 在过表达 HER2 的移植瘤模型中的体内抗癌活性。当小鼠接受靶向 Ag NPs 注射后再进行光照射治疗时,癌症得到缓解。
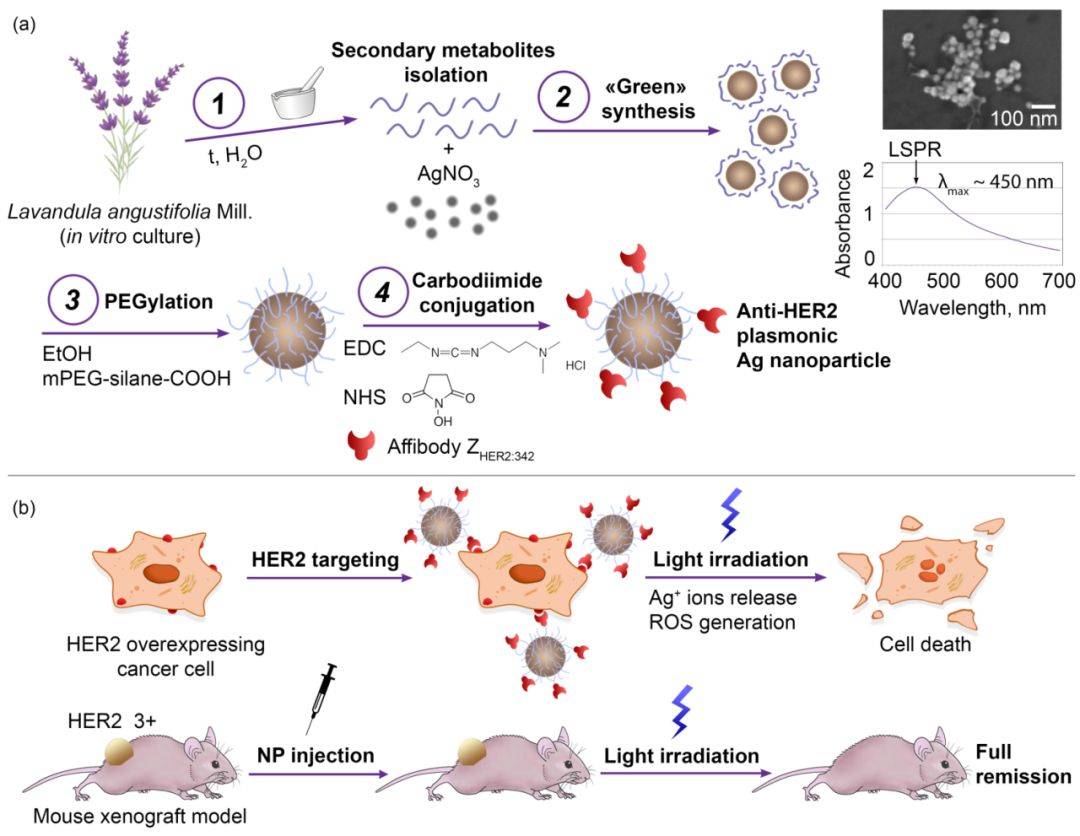
图1. 体外和体内 HER2 靶向光热疗法的 Ag NP 合成和修饰实验设计。
研究结果
1. AgNPs 修饰和靶向 HER2 过表达细胞
针对 HER2 过表达细胞的 Ag NPs (图2a) 通过中间的 PEG 化和随后的碳二亚胺与亲和体 ZHER2:342 缀合获得,合成的 Ag-PEG-HER2 NPs 同时具有特异性靶向 HER2 和热疗的特性。
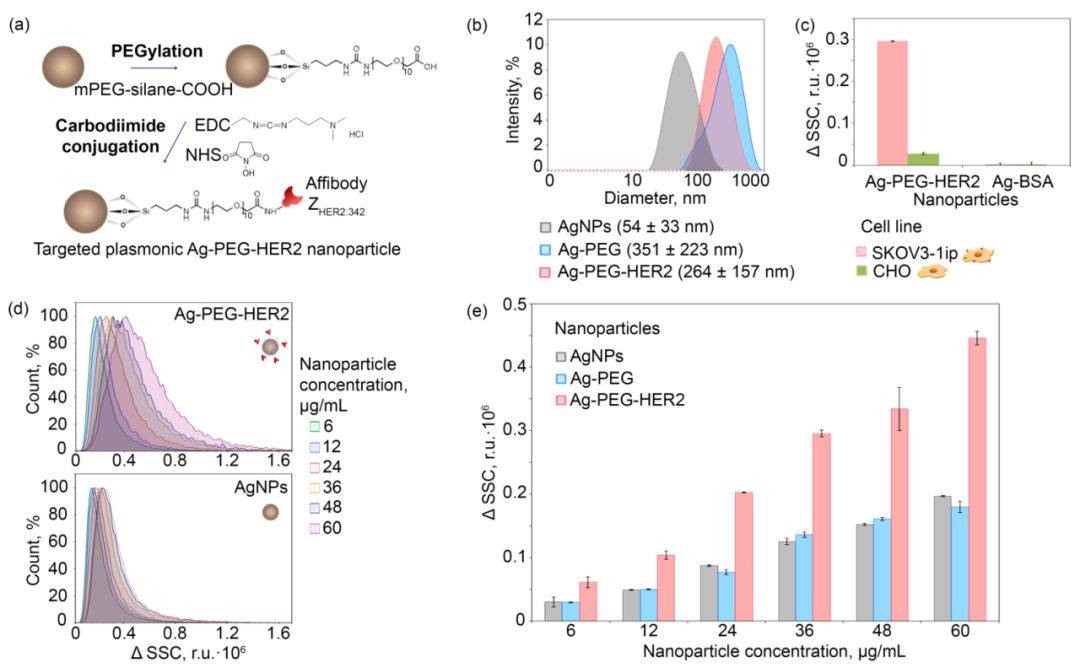
图2. 纳米粒子与 HER2 识别支架蛋白 ZHER2:342 的共轭和在体外试验中对 HER2 过表达细胞的靶向性。
2. 癌症光热治疗
将小鼠随机分为三组,分别为 (i) 组:瘤内只注射 Ag-PEG-HER2 纳米粒子,(ii) 组:瘤内注射 Ag-PEG-HER2 纳米粒子,然后进行光照射,(iii) 组-PBS (对照组)。三种治疗条件下的体内生物成像结果表明,靶向纳米颗粒 Ag-PEG-HER2 与光照射结合治疗的条件下,肿瘤的平均尺寸最小。此种方式不仅能消除原发肿瘤,而且能防止肿瘤的转移性扩散。
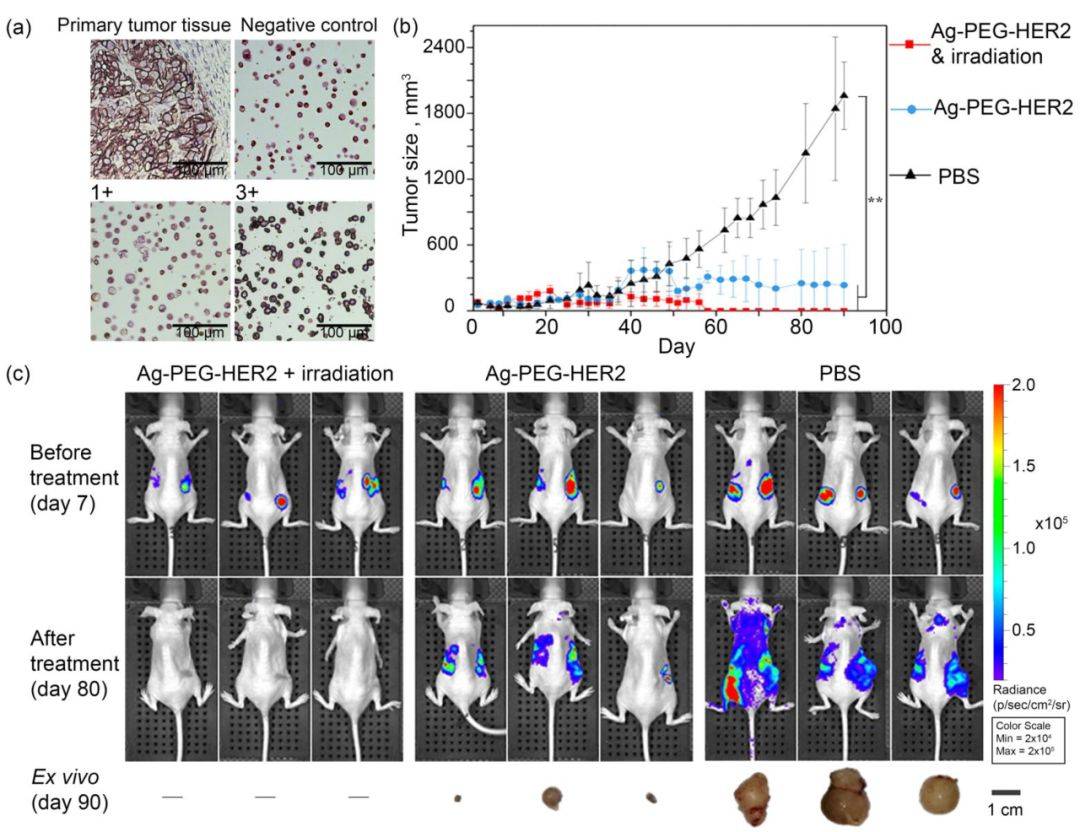
图3. 靶向 Ag-PEG-HER2 纳米粒子和光照射的异种移植肿瘤的 PTT。
研究总结
本研究发现基于 Ag NP 的增敏剂用于光热治疗可完全抑制肿瘤生长且防止其转移性扩散。Ag NPs 的 LSPR 特性通过在 HER2 阳性细胞内加热靶向纳米粒子而增强了治疗效果。Ag NPs 介导了光能向热能的转化,这导致了体外和体内的局部热疗和癌细胞死亡。基于这些肿瘤治疗结果,本研究认为靶向 LSPR-银纳米粒子是治疗侵袭性乳腺癌的下一代药物,Ag NPs 的绿色合成和 HER2 靶向剂 ZHER2:342 的有效生物技术生产,使所设计的靶向药物更加有希望迅速转化为临床实践的药物。
原文出自 Pharmaceutics 期刊
Shipunova, V.O.; Belova, M.M.; Kotelnikova, P.A.; Shilova, O.N.; Mirkasymov, A.B.; Danilova, N.V.; Komedchikova, E.N.; Popovtzer, R.; Deyev, S.M.; Nikitin, M.P. Photothermal Therapy with HER2-Targeted Silver Nanoparticles Leading to Cancer Remission. Pharmaceutics 2022, 14, 1013.

Pharmaceutics 期刊介绍
主编:Yvonne Perrie, University of Strathclyde, UK
期刊领域涵盖生物制药、药物递送、药物控释、药物制剂、药物靶向、药代动力学、纳米医学、药物遗传学、药物基因组学、药效学等。
2021 Impact Factor:6.525
2022 CiteScore:6.9
Time to First Decision:15.8 Days
Time to Publication:39 Days

