肿瘤免疫思路太老套?10+文章的氛围感用这个打造!
来源:小张聊科研平台的“ 课题指南针”公众号,微信公众号搜索“ 课题指南针”即可关注/扫描关注见文末
肿瘤微环境内的免疫细胞在肿瘤的发展和治疗中都起着关键作用,已知这些肿瘤浸润性免疫细胞可能具有拮抗或促进肿瘤的功能,其中,B细胞通过生发中心反应在肿瘤免疫中起关键作用,尤其是聚集形成三级淋巴结构 (Tertiary lymphoid structure,TLS)时。
研究表明,在大多数实体瘤中,TLS的存在与良好的免疫治疗反应和临床预后密切相关,这引起了人们的极大关注。

单细胞测序技术,这一场革命彻底改变了我们对肿瘤的认识,对肿瘤的细胞组成拥有了更广泛的见解。但通过单细胞视角,基于TLS的表达情况,去探索肿瘤微环境,这种极具创新的见解还未有人报道。
今天,让我们来一起解读这篇Clinical and Translational Medicine(IF=10.6)新鲜出炉的基于单细胞测序与TLS表达探索乳腺癌中肿瘤微环境(TME)的研究吧!
01、研究背景
乳腺癌是一种异质性很强的疾病,虽然,近年来免疫治疗提高了患者在各种实体或血液系统恶性肿瘤中的存活率,但大多数乳腺癌亚型对免疫检查点阻断治疗几乎没有反应。
三级淋巴结构是异位淋巴细胞聚集体,其主要是由B细胞富集形成,B细胞和TLS可能与更好的生存和治疗反应有关,这与TLS有助于促进有效的免疫环境有关。
越来越多的证据表明,在大多数类型的实体瘤中,TLS 的存在与降低复发风险和增强免疫检查点阻断治疗(Immune checkpoint blockade,ICB)的疗效密切相关。但仍需确定TLS的潜在预后作用和详细分子机制。
02、研究方法
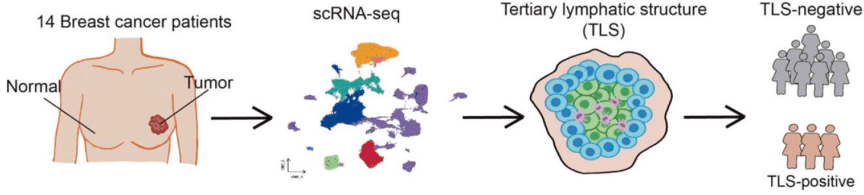
(1)收集14名乳腺癌患者的肿瘤和癌旁组织,进行单细胞测序实验,获取了8774个B细胞,进行身份鉴定、功能富集和拟时序分析。
(2)使用TCGA乳腺癌队列的RNAseq和H&E染色组织切片进行分析。
(3)基于70例乳腺癌肿瘤组织切片的H&E和CD23 IHC染色,鉴定TLS并明确其潜在生物标志物。
(4)对细胞测序的14例乳腺癌患者进行TLS鉴定,并依据TLS表达将其分为TLS-negative组和TLS-positive组,并进行两组间的TME中细胞间通讯和代谢差异比较。
(5)评估TLS在乳腺癌中的预后价值。
03、主要研究结果
1. BC中TIL-B异质性
对8774个TIL-B进行亚分类和功能富集,可分为5个簇:CXCR4+ B 细胞(B0)、生发中心B细胞(B1)、滤泡B细胞(B2)、浆细胞(B3)和幼稚B细胞(B4)。
作者意外地发现浆细胞中免疫球蛋白重链和轻链基因存在互斥表达。浆细胞和类别转换B细胞有相同的表现:重链基因IGHG、IGHA和轻链基因IGLC、IGKC存在相互排斥的差异表达。
这表明在乳腺癌中存在潜在TLS并发生局部持续类别转换重组。
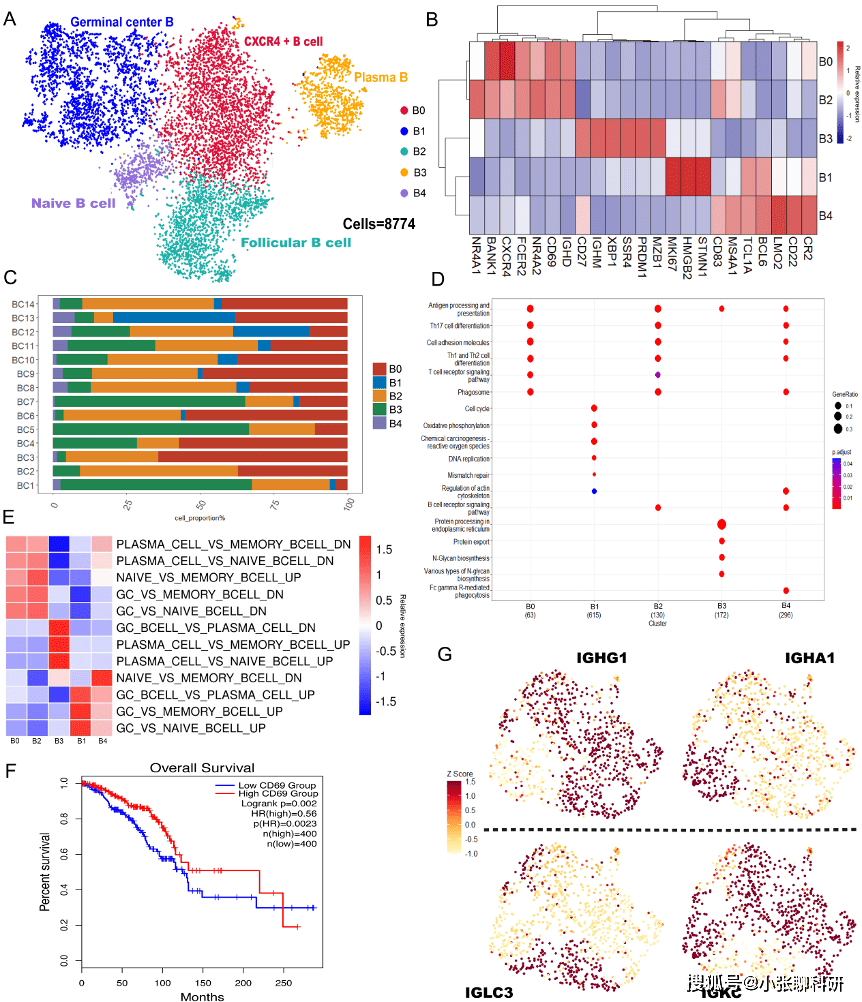
2. TIL-B与成熟TLS的相关性研究
接下来,该研究开始探讨TIL-B与TLS的关系。
为了验证上述推测,作者使用来自TCGA乳腺癌队列的H&E染色组织切片进行分析,以评估TLS的存在情况。
CD23最近被报道是滤泡树突状细胞(Follicular dendritic cell,FDC)的标志物,并且FDC上CD23的表达不依赖于肿瘤的CD23过表达。该研究通过IF发现CD23与FDC标记物CD21共定位,此外,还有研究报道CD23也表达于成熟TLS中,基于此,作者大胆推测,CD23或许是BC中成熟TLS的潜在生物标志物,并对其进行了验证。
通过对随机抽取的70例BC患者进行H&E和CD23的IHC染色,研究发现,通过H&E染色筛查到的每张切片中的成熟TLS数量明显低于通过CD23 IHC染色筛查到的成熟TLS数量(1.3 : 2.1),并且这两种方法之间的一致性适中(组内系数 0.75,95%CI 0.63-0.84;kappa 0.75,SE 0.089)。
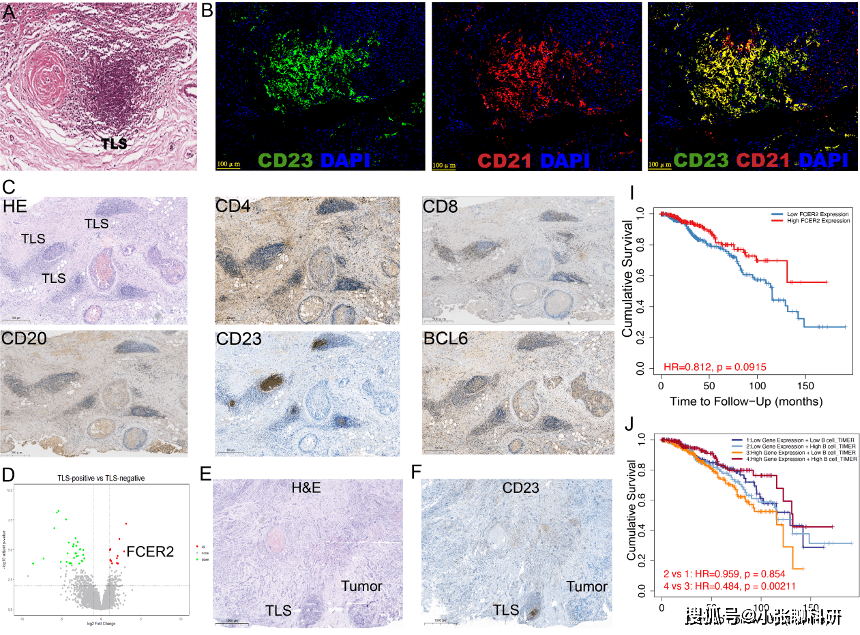
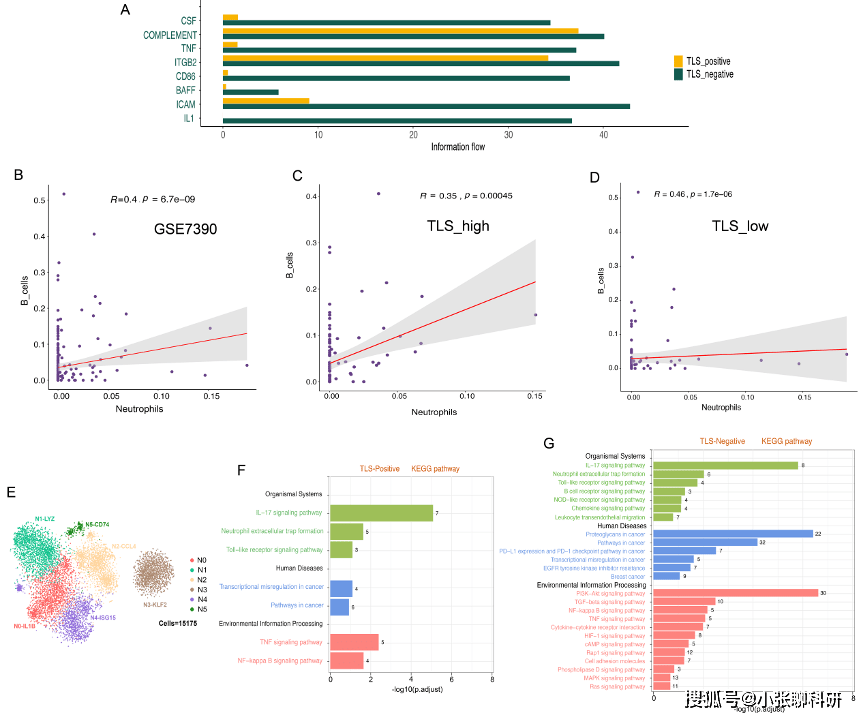
3. TLS状态对TME内细胞相互作用的影响
作者评估了已经进行过单细胞测序的14名患者的TLS情况,由于现实因素,经评估后,将3名BC患者纳入TLS阳性组,其余6名为TLS阴性组。
接着,作者进行了两组中的成纤维细胞和免疫细胞间的CellphonDB和Cellchat分析比较,发现TLS阴性患者存在潜在的免疫性抑制微环境。
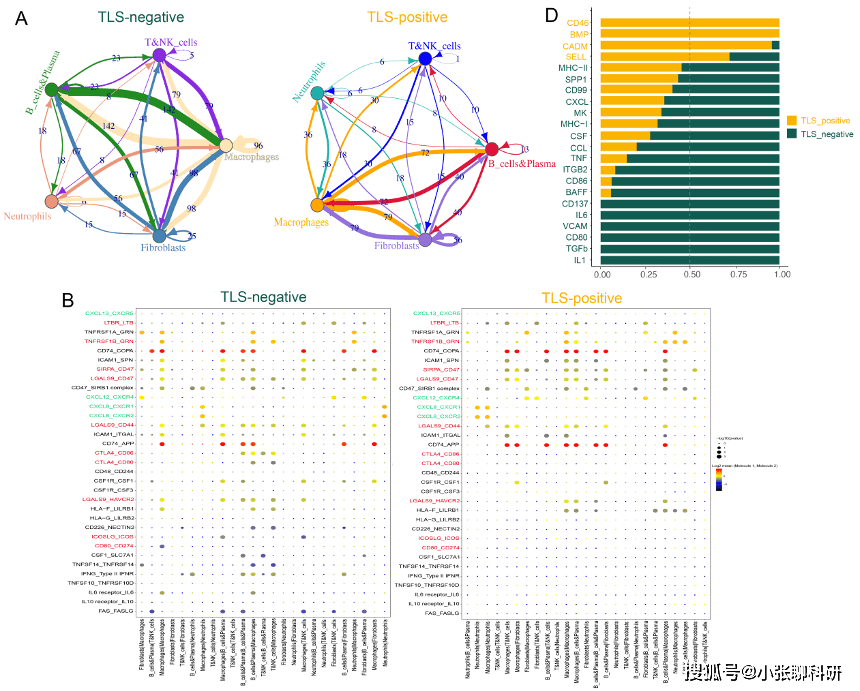
4. 不同TLS状态下TAN的可塑性
作者在研究中发现了一个有趣的现象:TLS阴性组中的TAN的BAFF和 TNF水平相对较高,但由于该研究中的数据集样本量较小,因此使用了反卷积算法CIBERSORTx来模拟细胞类型特异性基因表达谱并预测大规模scRNA-seq 数据集中每种细胞类型的丰度。
结果表明,与TLS-high组相比,TLS-low组中的TAN和TIL-B具有显著的正相关性,此外,还发现与TLS阳性组相比,TLS阴性组具有更高水平的炎症信号通路、PD-1检查点通路等,所有这些通路都与更具侵袭性和难治性的癌症有关。
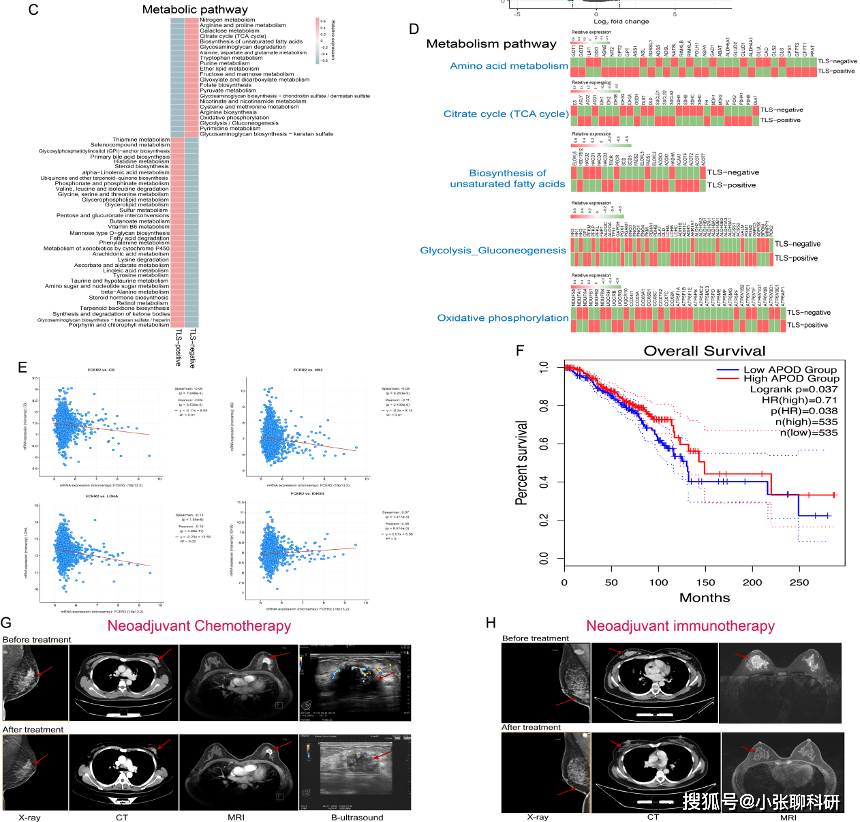
5. 不同状态TLS的代谢异质性和生存差异
作者使用了scMetabolism包对代谢途径进行评分,并在单细胞水平上分析两组免疫细胞的基因表达。令人惊讶的是,TLS阳性组和TLS阴性组间的免疫细胞具有完全不同的代谢途径。在TLS阴性组中,三羧酸循环(TCA循环)、糖酵解和脂肪酸产生均显著上调,并且这些代谢途径的激活被认为与癌发生、进展和耐药性密切相关。
此外,作者还在两名对新辅助免疫治疗和新辅助化疗有显著效果的BC患者的肿瘤组织中发现了TLS表达,反之,在治疗反应较差的乳腺癌患者中,并未发现TLS的存在。
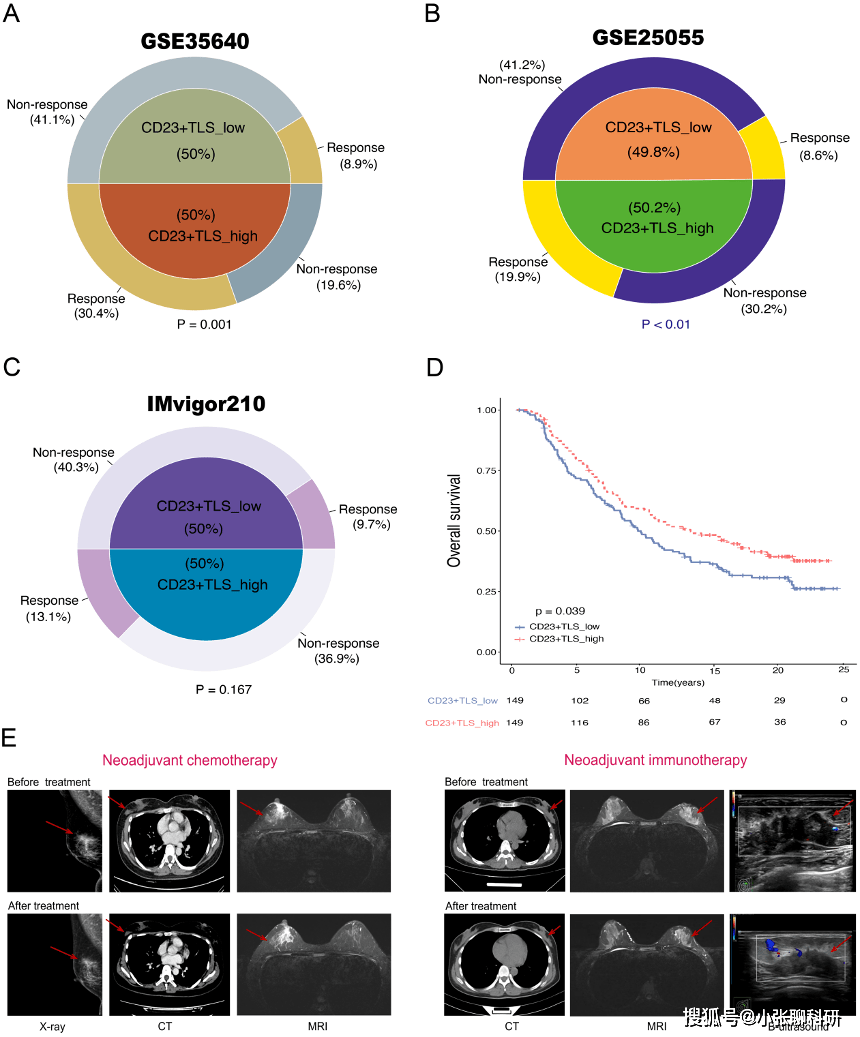
为了对这一发现进行验证,作者基于12 genes法将三个独立队列(GSE35640;GSE25055;IMvigor210)分为两组:CD23+TLS_low和 CD23+TLS_high,并比较他们对新辅助化疗和免疫治疗的反应。
在新辅助化疗BC 队列中,发现CD23+ TLS _high 患者表现出明显的化疗敏感性。同时,免疫治疗黑色素瘤队列中CD23+TLS _high的患者表现出显著的ICB敏感性。此外,尽管IMvigor210队列中高组和低组之间的免疫治疗反应没有显著差异,但CD23+TLS_high组具有更好的临床预后。
04、文章亮点
随着高通量测序时代的来临,单细胞数据分析已成为常规套路,从近几年的发文内容就可以看出,仅靠单细胞测序就想发高质量杂志是十分困难的。
但这篇文章,虽然使用的是单细胞分析的常规套路,且缺乏湿实验验证,却换了一个全新的切入点,以TLS的表达来分组,别出心裁,值得借鉴!
原文链接:https://mp.weixin.qq.com/s/ZYDgmVTnszdl0equGnuhVg
